EMA đánh giá vaccine VLA200 và xem xét cấp phép liều tăng cường Pfizer-BioNTech cho trẻ em
20/05/2022 08:03 GMT+7 | Tin tức 24h
Theo phóng viên TTXVN tại Brussels, Ủy ban về các sản phẩm thuốc dùng cho người của Cơ quan Dược phẩm Châu Âu (EMA), đã bắt đầu giai đoạn đánh giá khoa học chính thức đối với vaccine phòng COVID-19 của công ty Valneva , VLA200.
Valneva đã có thể đăng ký giấy phép tiếp thị có điều kiện cho vaccine dành cho người lớn từ 18 đến 55 tuổi.
Vaccine bất hoạt này do Valneva phát triển, đã được đánh giá tiến bộ kể từ ngày 2/12/2021. Thủ tục cấp phép có điều kiện này giúp tăng tốc độ đưa vào thị trường châu Âu các loại thuốc có triển vọng trong trường hợp khẩn cấp về sức khỏe cộng đồng trong thời gian một năm và có thể gia hạn.
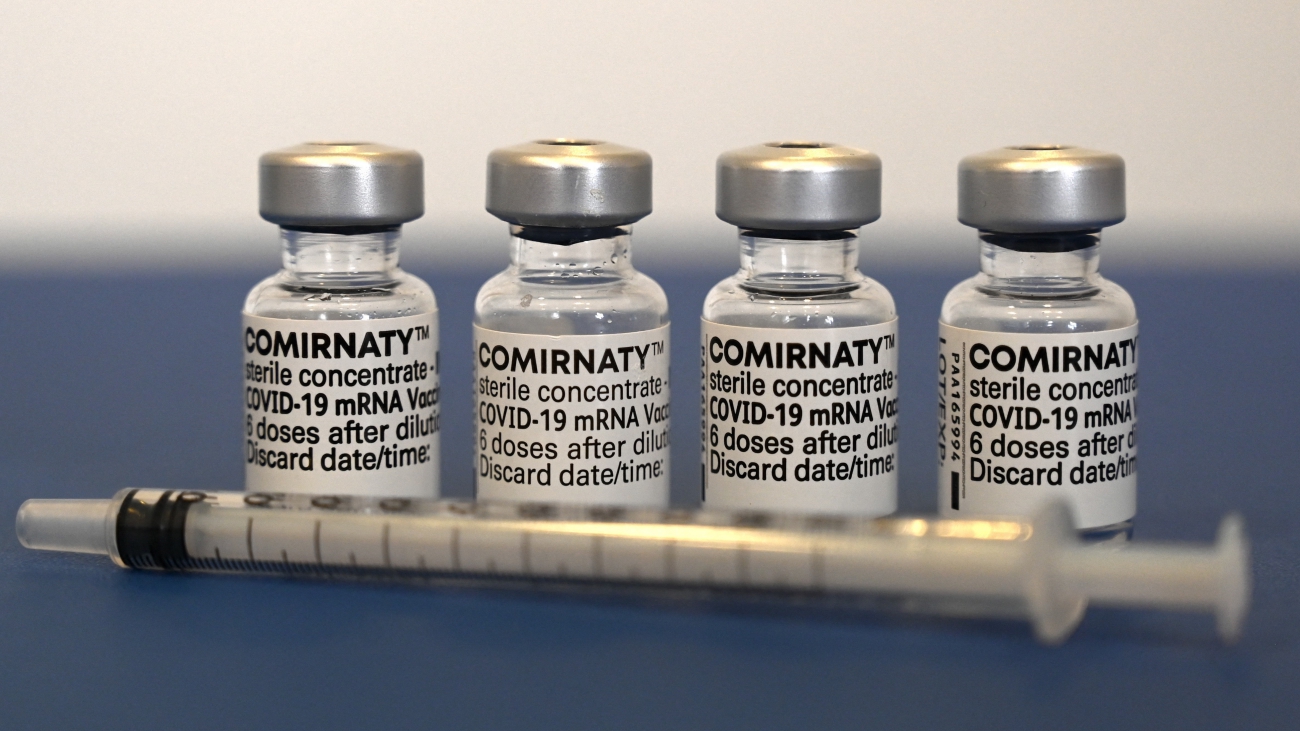
Ủy ban Châu Âu sẽ cấp phép có điều kiện, nếu EMA có khuyến nghị tích cực đối với vaccine này.
- Pfizer thúc đẩy điều chế vaccine ngừa Covid-19 cho trẻ em dưới 5 tuổi
- Pfizer có thể ra mắt vaccine chống lại nhiều biến thể vào cuối năm nay
- Pfizer xin cấp phép đối với vaccine dùng cho trẻ nhỏ
Ngày 16/5 vừa qua, Ủy ban về các sản phẩm thuốc dùng cho người của EMA đã bắt đầu đánh giá liều tăng cường của Comirnaty, vaccine RNA thông tin phòng virus SARS-CoV-2 do Pfizer-BioNTech phát triển, dành cho trẻ em từ 5 đến 11 tuổi.
Liều tăng cường Comirnaty đã được cấp phép cho người lớn vào ngày 22/4 và cho thanh thiếu niên từ 12 tuổi trở lên vào ngày 24/2.
Đức Hùng/TTXVN
-
 26/04/2024 21:50 0
26/04/2024 21:50 0 -

-

-

-
 26/04/2024 20:32 0
26/04/2024 20:32 0 -
 26/04/2024 20:27 0
26/04/2024 20:27 0 -

-
 26/04/2024 20:00 0
26/04/2024 20:00 0 -
 26/04/2024 19:49 0
26/04/2024 19:49 0 -

-

-

-
 26/04/2024 19:43 0
26/04/2024 19:43 0 -
 26/04/2024 19:43 0
26/04/2024 19:43 0 -
 26/04/2024 19:42 0
26/04/2024 19:42 0 -
 26/04/2024 19:40 0
26/04/2024 19:40 0 -
 26/04/2024 19:38 0
26/04/2024 19:38 0 -

-

-

- Xem thêm ›

